◎欢迎参与讨论,请在这里发表您的看法、交流您的观点。

DS8201(Enhertu®,Daiichi Sankyo)自2019年底,先后获得FDA批准用于治疗HER2阳性乳腺癌,HER2低表达乳腺癌,HER2阳性胃癌等多个适应症。2024年4月,FDA再次宣布加速批准其用于治疗不可切除或转移性HER2阳性实体瘤患者。基于在临床前实验和临床治疗HER2+ (IHC 3+或HER2 IHC 2+/FISH+)和HER2-low (IHC 1+或IHC2+/FISH-)癌症中的优异表现,DS8201用于治疗更多适应症的研究也在不断开展。另一方面,虽然DS8201在治疗HER2表达的实体瘤中显示出显著的疗效,但治疗后疾病进展仍然是一个挑战。由于ADC药物的结构和作用机制的复杂性,DS8201的耐药机制涉及包括抗原的表达与识别,payload的释放与凋亡调控等在内的多个环节。了解耐药机制进一步提高药物治疗效果、开发新一代ADC、提高临床转化率、促进联合治疗策略也已成为热点与重点,被广泛关注。
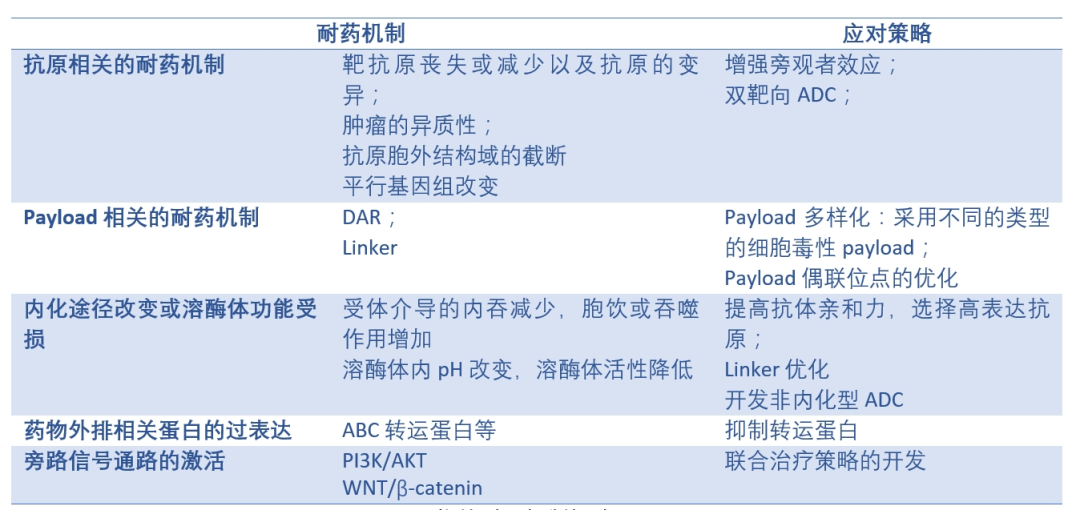
ADC药物的耐药机制概述(Ref.1)
利用经过临床DS8201治疗后进展的肿瘤组织建立的患者来源的异种移植的小鼠体内模型(PDX),可以更好的在临床前药理药效研究中,模拟病人的肿瘤组织的生物学特性和临床药效反应,具有更高的临床相关性,对于新一代的ADC药物或治疗策略的临床转化提供更加精准的预测。
LU9681为基于一例经过DS8201临床治疗后进展的非小细胞肺癌(NSCLC)患者的转移病灶活检样本,建立的HER2表达的DS8201临床经治耐药肺癌PDX模型。

活检组织来源患者相关信息

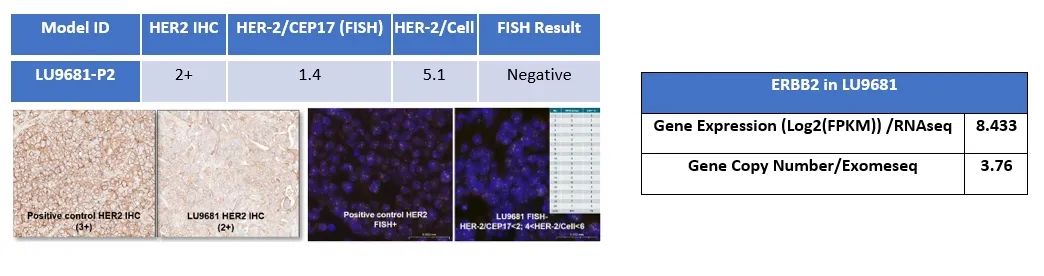
LU9681 PDX模型生物学特性
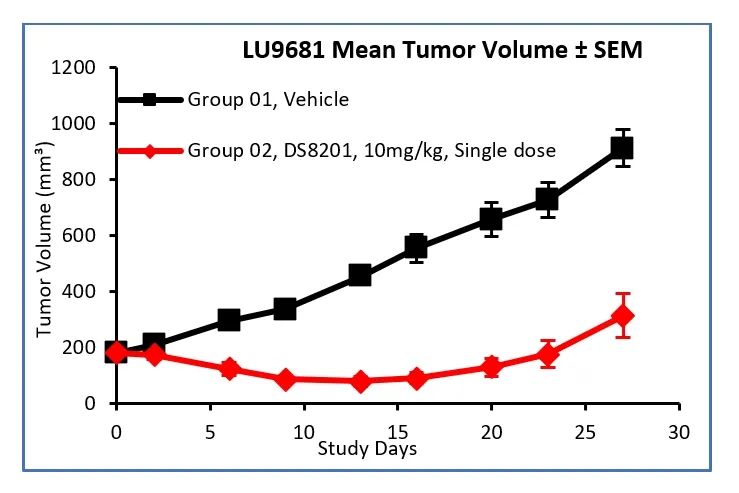
DS8201在LU9681PDX模型中的体内药效反应:尽管在实验初期, DS8201对肿瘤生长产生了一定的抑制作用,但治疗组的小鼠从给药后的第16天或第27天均开始出现不同程度的肿瘤体积增长。参考临床治疗中实体肿瘤临床疗效评价标准(RECIST1.1),我们对接受DS8201治疗的个体进行了进一步的治疗反应评估(RECIST-Based Response):五只小鼠在实验终点(Day 27)时的瘤体积相比于实验过程中瘤体积的最小值均增加了至少20%,可见明显的肿瘤复发,与患者在临床上的治疗反应一致。
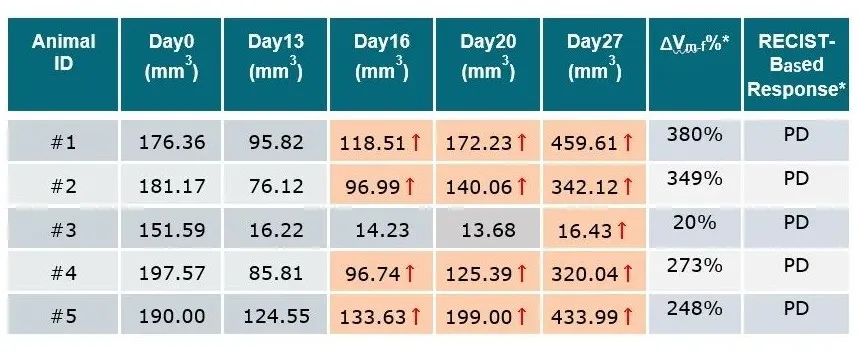
* 根据瘤体积增长比例∆Vm-f %(以治疗期间瘤体积最小值为参考,∆Vm-f %=100% × ((Vfinal – Vminimum) / Vminimum)),基于临床治疗中实体肿瘤临床疗效评价标准(RECIST1.1) (Ref.2),我们对治疗组小鼠在实验终点时的治疗反应,基于RECIST1.1进行评定(RECIST-Based Response),标准如下:CR(Complete Response) – 终点时肿瘤完全消失;PR(Partial Response) – 以实验起始点Day 0的瘤体积为参考,终点时肿瘤体积至少减少30%;PD(Progressive Disease) – 以实验中瘤体积最小值为参考,终点时肿瘤体积至少增加20%;SD(Stable Disease) – 既没有达到PR标准的瘤体积减少,也没有达到PD标准的瘤体积增加。为了更准确地体现肿瘤复发与进展,即使在治疗初期表现出显著的肿瘤缩小,但如果在后续治疗过程中肿瘤再次显著增大并符合PD标准,则将其评估为PD。
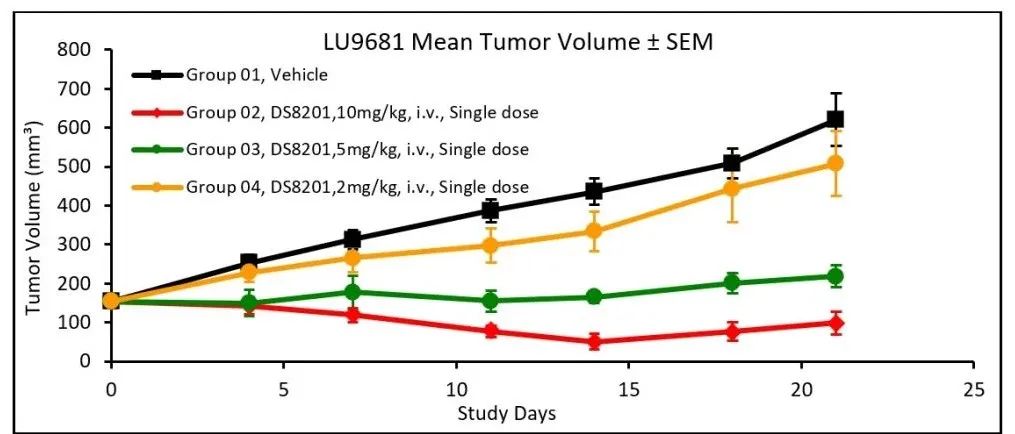
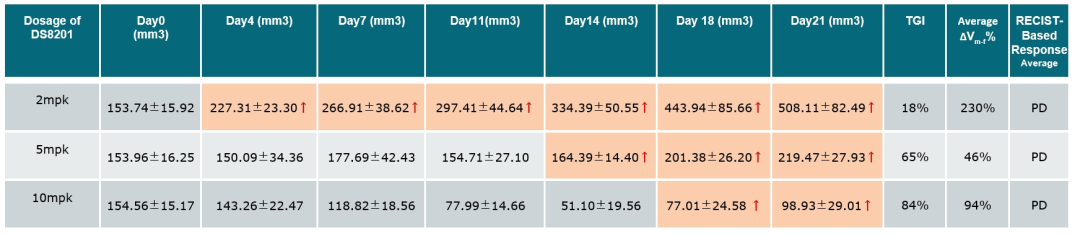
在早期的临床前药效实验中,从1mpk到10mpk不同剂量下的DS8201对HER2阳性CDX模型的体内生长均有明显的抑制效果 (Ref. 3)。在另一个体内药效实验中,我们也进一步地测试了不同剂量的DS8201在LU9681模型上的体内药效反应。与之前的实验中所观察到的结果一致,在接受10mpk 剂量治疗一段时间后,肿瘤出现了明显的复发,平均瘤体积增长比例Average ΔVm-f%达到94%。在2mpk的治疗剂量下,肿瘤则呈现持续进展,Average ΔVm-f%达到230%。5mpk DS8201的治疗对于肿瘤生长的抑制效果介于2mkp和10mpk的治疗剂量之间,且肿瘤也出现明显进展,Average ΔVm-f%达到46%。此实验还在持续进行中,并参考DS8201在临床治疗中的用药方案,进行每3周一次给药,持续5轮的治疗。
Reference
1. Saleh, Khalil, et al. "Mechanisms of action and resistance to anti-HER2 antibody-drug conjugates in breast cancer." Cancer Drug Resistance 7 (2024): N-A.
2. Eisenhauer, Elizabeth A., et al. "New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)." European journal of cancer 45.2 (2009): 228-247.
3. Ogitani, Yusuke, et al. "DS-8201a, a novel HER2-targeting ADC with a novel DNA topoisomerase I inhibitor, demonstrates a promising antitumor efficacy with differentiation from T-DM1." Clinical Cancer Research 22.20 (2016): 5097-5108.
更多临床耐药PDX模型
Trop2-ADC (Sacituzumab govitecan)临床经治耐药PDX模型:BR9690,BR9806,BR9801 (同病人来源匹配模型)
CDK4/6抑制剂(Palbociclib ;Ribociclib)临床经治耐药PDX模型:BR9697;BR9698;BR9819
PARP抑制剂(Olaparib ;Niraparib)临床经治耐药PDX模型:BR9671,BR9679,BR9815(同病人来源匹配模型);OV9563,OV9568(同病人来源匹配模型)
EGFR抑制剂(Osimertinib)临床经治耐药模型:LU9906( EGFR mt: E19 del/T790M/C797S)
KRASG12C抑制剂(AMG510;MRTX849 )临床经治耐药模型:LU22001;LU22001(同病人来源匹配模型);CR9528;CR9537;CR9547(同病人来源匹配模型)
关于我们
冠科生物成立于2006年,现为JSR生命科学集团旗下子公司。公司总部位于加利福尼亚圣地亚哥,在美洲、欧洲、亚洲都设有分公司及研发中心。作为一家临床前CRO公司,冠科生物为客户提供临床前及转化医学平台服务,专注于肿瘤、肿瘤免疫领域的体内外药物发现与研发。冠科生物拥有全球范围内可观的可商用PDX模型库。作为获得荷兰HUB独家授权的临床前CRO,可使用其技术为客户提供肿瘤类器官商业化服务。仅2021年,冠科生物就为FDA审批通过的13款肿瘤药物中的6款做出了贡献。冠科生物助力客户选择更有效的肿瘤候选药物,以确保病人“病有所医,及时医治”。

关注“冠科生物科技”订阅号

关注“冠科生物CrownBio”服务号
商务合作请邮件至:BDChina@crownbio.com
◎欢迎参与讨论,请在这里发表您的看法、交流您的观点。

工作时间:8:00-18:00
电子邮件
扫码二维码
获取最新动态
